Institut Charles Sadron MCUBE
Recherche
Visit Mcube Team website
L’équipe Mcube Physique des Membranes et Matière Molle regroupe des théoriciens et des expérimentateurs partageant un intérêt commun pour la physico-chimie et la physique de la matière molle. Dotée d’une expertise historique dans l’étude des systèmes lipides, l’équipe a élargie ses thèmes de recherche à l’étude des systèmes colloïdaux actifs et voit avec bienveillance l’émergence de thématiques nouvelles et interdisciplinaires au sein de ce large périmètre. Les membres de l’équipe s’investissent aussi de façon significative dans des missions d’enseignement, en particulier dans les formations de physique de la matière condensée. Nos thèmes de recherches s’insèrent harmonieusement dans les axes de recherches prioritaires de l’Institut Charles Sadron :
- Aspects fondamentaux des polymères et de la matière molle,
- Autoassemblages,
- Matière molle aux interfaces.
Systèmes Actifs
Antonio Stocco, Pierre Muller, Tatiana Schmatko, Thierry Charitat, Igor Kulic
Collab. externe Université Paris (Ali Abou-Hassan), Dresde (Juliane Simmchen Allemagne), Haute-Alsace (Laurent Pieuchot Mulhouse), ILL Grenoble/ESS Lund (Giovanna Fragneto), Synchrotron Soleil (Jean Daillant)
Au cours des prochaines années nous projetons d’étudier expérimentalement des situations impliquant des interactions entre particules solides et interfaces hors d’équilibre, que ce soit du fait d’une consommation locale d’énergie ou de la présence d’un gradient thermique ou physicochimique. Les membranes lipides de vésicules géantes et les interfaces liquide-solide seront les deux géométries interfaciales privilégiées de ces études.
Des vésicules géantes unilamellaires seront utilisées à cause de leur propension à subir des transformations complexes tels qu’endocytose, transitions morphologiques, division, bourgeonnement[1]... Un premier projet soutenu par un financement ANR PRC EDEM (2020-) permet d’envisager l’étude systématique d’interactions entre particules actives et vésicules géantes (Clément Marque, doctorant). La contrepartie solide pourra prendra la forme de particules colloïdales Janus actives traditionnelles dont l’activité repose sur la décomposition du péroxyde d’hydrogène catalysé par un revêtement de platine, mais aussi de particules uniformes rendues asymétriques par la proximité ou l’interaction avec l’interface. Des particules propulsées par la lumière (collaboration Université de Paris), des particules sphériques et des bâtonnets aux propriétés photocatalytiques et photothermiques (collaboration Université de Dresde) complèteront le dispositif expérimental.
Nous souhaitons de la sorte étudier et reproduire la dynamique des virus, bactéries et autres colloïdes au contact de membranes biologiques dans des processus tels que l’infection microbienne, la vectorisation de principes actifs et la toxicité de certains nanomatériaux[2]. Les membranes agissent habituellement comme des barrières s’opposant à l’internalisation de composés étrangers. Au cours des processus endocytiques la membrane lipide enrobe le corps étranger, puis referme et scelle la jonction avec la membrane extérieure (Figure 1). L’endocytose met donc en jeu des notions apparentées au mouillage, à l’énergie de courbure et la réorganisation topologique de la surface membranaire. De nombreux aspects chimiques et physicochimiques impliqués méritent d’être élucidés et requièrent un effort expérimental dans cette voie[1,2,3]. Les particules actives en interaction avec des vésicules géantes constituent donc dans ce contexte un équivalent biomimétique de l’activité endocytique de cellules biologiques.
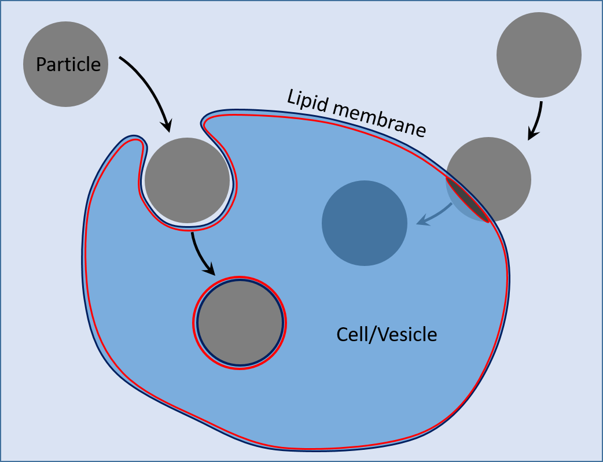
Figure 1. Schéma représentant un processus endocytique (à gauche) une particule en provenance du milieu extérieur s’entoure d’une membrane et pénètre enrobée dans la vésicule. A droite la particule traverse la membrane sans enrobage et se plonge dans le fluide occupant l’intérieur de la vésicule.
Au cours du précédent contrat, Igor Kulic et ses collaborateurs ont mis en évidence la possibilité d’animer de simples fibres de plastique d’un mouvement entretenu de rotation capable fournir un travail mécanique équivalent à celui d’un moteur miniature (fiberdrive)[4]. Rapidement il est apparu qu’il s’agissait là d’un mécanisme universel de conversion de gradient physico-chimique (thermique, hydratation, osmotique…) en travail et en mouvement[5]. L’idée fut rapidement étendue à l’étude de la mobilité active de virus de forme anisotrope ou enrobés d’une membrane (filovirus, torovirus, Ebola, Influenza, SarsCov) pour lequel un modèle original a été proposé[6] (Figure 2).
La question centrale soulevée par ces études est celle d’amener une compréhension générale de la manière dont des systèmes biologiques ou biomimétiques peuvent répondre à la présence de gradients présents dans l’environnement et convertir ceux-ci en une actuation, en un mouvement ou une auto-organisation. Cela s’est concrétisé en premier lieu par l’obtention d’un financement ANR-DFG PRCI franco-allemand RodRolls (2020-). Le projet vise à reproduire un analogue du mouvement de rotation présumé des virus filaments à l’aide de bâtonnets colloïdaux stimulés par un signal chimique ou lumineux (Ann-Rosna George, doctorante). Ce projet a pour ambition de mettre en mouvement de la sorte un ensemble d’objets afin qu’en émerge des propriétés dynamiques collectives.
Le phénomène de mise en mouvement repose sur une bifurcation d’un état de repos vers un état dynamique autoentretenu dont le sens de rotation n’est pas prescrit ni codé à l’avance dans l’objet étudié. Il s’agit donc d’un choix aléatoire et spontané au départ, dont le caractère dynamique dépend d’un diagramme de stabilité contrôlé par le forçage extérieur et la dissipation. Il sera particulièrement instructif d’aborder des situations dans lequel des obstacles viendront perturber le mouvement, afin de déterminer dans quelle mesure ces systèmes actifs seront capables de résoudre des tâches telles que le contournement d’un obstacle ou la sortie d’un labyrinthe. Ces questions pourront aussi recevoir l’appui de simulations numériques réalisées au sein de l’équipe.
Nous nous intéresserons également à l’amplification coopérative de la réponse de systèmes sensibles à l’environnement, physicochimique ou thermique. Ainsi un arrangement approprié d’unités responsives connectées peut mener à des changements conformationnels spectaculaires. Une telle coopérativité a déjà été démontrée dans le cas de filaments biologiques (actine, microtubules, filaments intermédiaires)[7-10]. Nous étudions actuellement le cas particulier des ‘R-bodies’ bactériens. Il s’agit d’organelles subcellulaires prenant la forme de feuillets-rubans enroulés, et capables de transiter d’une forme compacte inférieure à 0.5 µm à une forme allongée en forme d’aiguille de 20 µm de long, le tout en une fraction de seconde, et sous l’effet d’un changement du pH de la solution environnante. Cette étude en collaboration avec l’Université de Haute-Alsace bénéficie d’un financement Seed Money de l’Institut Thématique Interdisciplinaire HiFunMat.
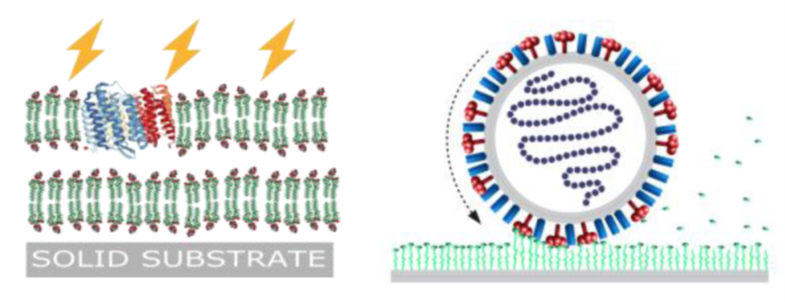
Figure 2 : À gauche : schéma représentant l’insertion d’une bactoriorhodopsine dans une double bicouche supportée. À droite : membrane virale accomplissant un mouvement de rotation actif.
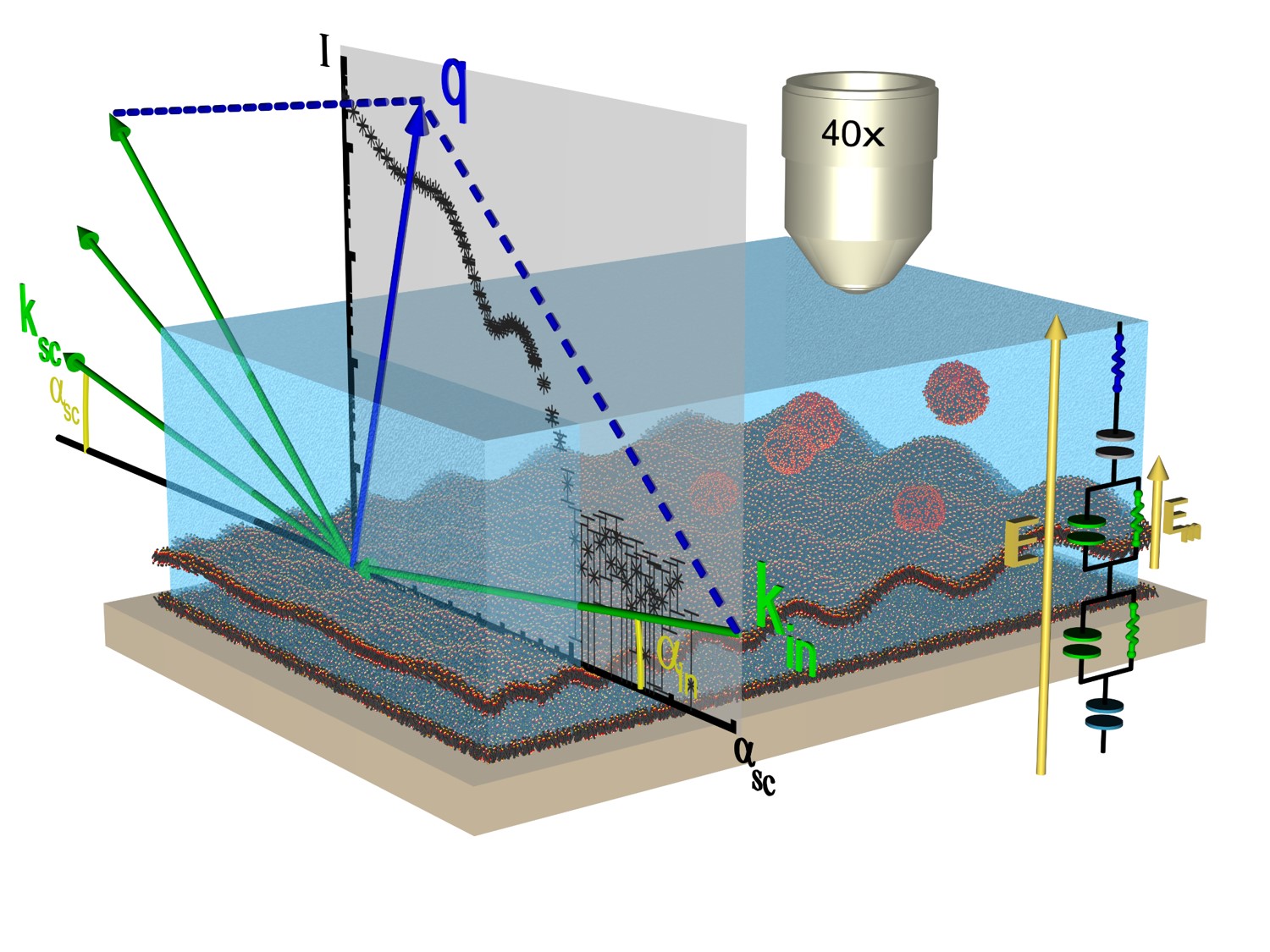
Le dernier projet emblématique porte sur l’étude de bicouches lipides rendues active par l’insertion d’un complexe protéique bactérien appelé bactériorhodopsine. Ce complexe protéique membranaire est responsable de la photosynthèse énergétique des bactéries pourpres et utilise une voie non chlorophyllienne. Ce complexe peut être reconstitué artificiellement au sein d’une double bicouche lipide supportée et étudiée par une méthode de réflectivité hors spéculaire maîtrisée depuis longtemps dans l’équipe (collaboration Soleil, ILL, ESS). Il a d’ores et déjà permis d’obtenir pour la première fois un spectre expérimental de fluctuations d’une membrane active, attendu depuis longtemps par la communauté des biophysiciens[11] (Figure 2). De nombreuses études supplémentaires permettront d’affiner la compréhension structurale et dynamique de tels systèmes complexes.
Frictions
Pierre Muller, Thierry Charitat, Fabrice Thalmann, Antonio Stocco, Marc Basler
Internal collaboration: MIM (Damien Favier, Anne Rubin, Christian Gauthier)
External collaboration: ILM Lyon (Claire Loison, Laurent Joly)
La mesure des forces et la détermination de l’origine de leurs causes est depuis toujours l’apanage des physiciens. Des forces et autres actions mécaniques de dimensionnalité variée (tension de ligne, tension de surface, contraintes) émergent en réponse à des déplacements de matière ou des hétérogénéités physico-chimiques. Citons par exemple la tension de surface d’un fluide ou les effets mécaniques d’un gradient d’hydratation au cours de l’imbibition d’un dépôt de lipides (pousse sur gel) ou du séchage d’une suspension colloïdale concentrée (filmification).
Nous avons entrepris d’étudier en détail les mécanismes intimes accompagnant le déplacement relatif de deux surfaces revêtues d’un film moléculaire de phospholipides et les contraintes de friction résultantes. Cette classe de systèmes est connue pour exhiber de faibles coefficients de friction, mécanisme mis à profit dans le vivant pour permettre le mouvement de glissement relatif de deux tissus, et connu sous le nom de biolubrification. Notre projet consiste à mesurer le plus précisément possible les vitesses de glissement accompagnant la friction des surfaces macroscopiques, en s’appuyant sur un développement instrumental : la mise au point d’un dispositif de mesure unique dit TriboFrapp[12]. Ce projet est soutenu par le financement ANR PRC BananaSlip (2020) et bénéficie du travail de Swen Helstroffer (doctorant). L’originalité de l’approche résulte d’une part de la maîtrise de l’élaboration de l’échantillon (dépôt de Langmuir-Blodgett) et de l’utilisation d’un dispositif de mesure par photoblanchiment de franges de fluorescence (FRAPP). Les travaux entrepris permettront la compréhension à un niveau de détail inégalé des phénomènes de friction interfaciale à l’œuvre dans ces systèmes, dans une large gamme de conditions expérimentales (surfaces neutres et chargées, taux d’humidité et température contrôlées).
Le projet possède un volet théorique et numérique essentiel. Notre équipe étudie la friction à l’échelle moléculaire dans les bicouches de phospholipides[13] et collabore avec une équipe de l’ILM Lyon. A cette échelle-là, les mécanismes de dissipation liées à la théorie de la réponse linéaire prédominent. Un effort conceptuel est donc nécessaire pour relier des mesures moléculaires aux coefficients de friction macroscopiques mesurés expérimentalement. Le banc de mesure TriboFrapp n’est pas le seul instrument en notre possession pour mesurer des forces de friction. Nous disposons également du dispositif de pinces optiques couplés à l’imagerie par microscopie, d’un montage de manipulation de vésicules géantes ou microgel par micropipette, et notre équipe pourra enfin mettre en œuvre des mesures par microscopie à force atomique (AFM) présente dans le laboratoire.
Interaction polymères membranes, toxicité membranaire des nanoplastiques.
Antonio Stocco, Fabrice Thalmann, Tatiana Schmatko
Internal collaboration: Marc Schmutz (Sycommor)
Polymères et membranes sont des objets centraux de la physique de la matière molle, duaux par leur dimensionnalité et en permanente interaction[14]. La présence de polymères aux voisinages de membrane peut être intentionnelle comme dans le cas du greffage d’une chaine hydrosoluble sur la tête d’un lipide (typiquement PEGylation) ou fortuite comme lorsque l’environnement apporte sous forme de nanoparticule ou de chaines solubles des chaines venant au contact de la bicouche lipide (par exemple des peptides amphiphiles). Les mécanismes d’interaction polymère-membranes sont très riches et mettent en jeu des concepts physico-chimiques (interaction électrostatique, hydrophiles ou hydrophobes) et théorique statistique (conformation des polymères, brosses, boucles, interactions multiples).
Notre contribution à la thématique polymère-membranes prend plusieurs formes. A l’échelle macroscopique le montage pinces optiques permet de mettre en contact des nanoparticules polymères (polystyrène, mélamine, etc) et de mesurer quantitativement les forces induites par l’interaction avec une vésicule géante de composition choisie. Cela autorise une large gamme de variation de propriétés physicochimiques (charge, adhésion, mouillage…) à l’interface nanoparticule membranes. L’étude de l’enrobage et des interactions entre nanoparticules de plus petite taille a elle fait l’objet de précédents travaux dans l’équipe, et repose sur l’imagerie par cryoTEM de systèmes liposomes nanoparticules[15].
Dans la foulée d’une contribution récente à l’étude des interactions polystyrène membrane nous souhaitons aborder dans l’équipe la question de la possible nanotoxicité des microplastiques dans l’environnement. Nous approchons cette thématique sous l’angle de la pénétration d’oligomères et de polymères hydrophobes à l’intérieur du cœur d’une bicouche et de l’étude des modifications structurales, thermodynamiques et dynamiques qui en résultent. Un premier travail expérimental significatif[16] a permis de dégrossir certains points relatifs à la préparation des échantillons et à la mise en évidence de la présence des oligomères synthétiques dans ces membranes. Fort de cette expérience nous envisageons d’approfondir cette thématique en mettant en œuvre de nouvelles approches expérimentales et théoriques. Expérimentalement, il s’agit d’approfondir et d’explorer les diverses possibilités expérimentales s’offrant à nous pour 1/ perfectionner les méthodes d’élaboration permettant d’insérer des polymères synthétiques variés au sein de bicouches lipides, 2/ quantifier expérimentalement la présence et les modifications induites par cette présence dans les bicouches, 3/ anticiper et rationaliser les conséquences biophysiques d’une telle insertion sur le vivant. D’un point de vue théorique et numérique des questions se posent tant du point de vue formel portant sur la statistique de conformation des chaines polymères et la conséquence sur les modifications physiques de la membrane que du point de vue des simulations visant à décrire les modification structurales et thermodynamiques des bicouches et de leur dynamique (Figure 3).
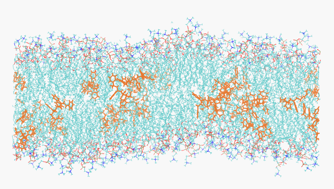
Figure 3. Simulation par dynamique moléculaire d’oligomères de polystyrène (orange) dispersés dans une phase fluide de DPPC (333K) (bleu). Configuration lipides Charmm36/eau TIP3P. T. Espinosa de Oliveira, image F. Thalmann.
Modèles : théorie, simulations et Intelligence Artificielle
Fabrice Thalmann, Igor Kulic, Jean Wolff
Collab interne Marc Schmutz (Sycommor) Olivier Benzerara (TSP) externe Vivien Walter (King’s College London) Céline Ruscher (Univ Colombie Britannique, Canada)
Notre équipe a une prédilection pour les problématiques présentant une complémentarité entre théorie et expérience, et nous tentons systématiquement d’interpréter les résultats expérimentaux que nous obtenons à l’aide de modèles existants ou originaux. Cette démarche répandue dans l’étude des systèmes complexes se prête volontiers au qualificatif de phénoménologie. Ainsi les études expérimentales portant sur l’hydropéroxidation des lipides ont donné lieu à des interprétations[17] et suscité le développement de modèles originaux de dynamique moléculaire à gros grains[18,19].
L’interprétation des perturbations de transition de fusion des lipides causée par la présence d’agents hydrophiles[20] ou hydrophobes[16] nous ont conduits à étudier de près à l’aide de simulations certains aspects de ces transitions de phase et à les interpréter à l’aide d’approches originales de Machine Learning[21,22]. Nous allons poursuivre dans cette direction en mettant à profit par exemple les réseaux de neurones convolutionnels (CNN) pour interpréter à la volée les trajectoires de dynamique moléculaires de bicouches lipides en présence d’agents extérieurs (nanoplastiques, composés hydrophiles). La classification ML/IA des conformations des lipides se pose comme une alternative intéressante aux critères plus traditionnels que sont les paramètres d’ordre habituels décrivant les différentes phases de lipide (Figure 4).
Plus largement nous mettrons aussi à profit ces méthodes d’analyse statistiques avancées pour l’interprétation d’images de cryoTEM de liposomes (peroxydés ou en présence d’agents perturbateurs) afin d’en améliorer le contraste par addition statistique.
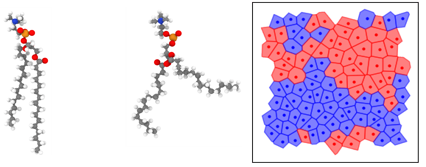
Figure 4: Représentation de conformations de lipides classés à l’aide d’un algorithme de Machine Learning et identification à la volée de domaines gel-fluide dans une bicouche lipide à partir de trajectoires de dynamique moléculaire.
Des thèmes théoriques plus traditionnels seront également poursuivis, tels que la compréhension des interactions microscopique et la thermodynamique des mélanges lipides, les couplages courbure concentration dans les membranes[23], l’étude du séchage des solutions et la déformation de particules polymères sous l’influence de la tension de surface et d’une pression externe appliquée.
Références
[1] F. Frey & T. Idema, More than just a barrier: using physical models to couple membrane shape to cell function, Soft Matter 17, 3533–3549 (2021).
[2] J. Agudo-Canalejo & R. Lipowsky, Critical particle sizes for the engulfment of nanoparticles by membranes and vesicles with bilayer asymmetry, ACS Nano 9, 3704–3720 (2015).
[3] S. Zhang, H. Gao & G. Bao, Physical principles of nanoparticle cellular endocytosis, ACS Nano 9, 8655–8671 (2015).
[4] A. Baumann et al, Motorizing fibres with geometric zero-energy modes, Nature Materials 17, 523 (2018).
[5] A. Bazir, A. Baumann, F. Ziebert & I. M. Kulic?, Dynamics of Fiberboids, Soft Matter ,16, 5210 (2020).
[6] F. Ziebert & I.M. Kuli? , How Influenza’s Spike Motor Works, Phys. Rev. Lett. 126, 218101 (2021).
[7] H. Mohrbach & I.M. Kuli?, Motor driven microtubule shape fluctuations-force from within the lattice, Phys. Rev. Lett. 99, 218102 (2007).
[8] H. Mohrbach, A. Johner & I.M.Kuli?, Tubulin Bistability and Polymorphic Dynamics of Microtubules. Phys. Rev. Lett. 105, 268102. (2010).
[9] F. Ziebert, H. Mohrbach & I.M. Kuli?, Why Microtubules run in Circles - Mechanical Hysteresis of the Tubulin Lattice, Phys. Rev. Lett. 114, 147101 (2015).
[10] L. Bouzar et al. Helical Superstructure of Intermediate Filaments, Phys. Rev. Lett. 122, 098101 (2019).
[11] T. Mukhina et al., Insertion and activation of functional Bacteriorhodopsin in a floating bilayer, Journal of Colloid and Interface Science 597, 370-382 (2021).
[12] L. Fu et al. A new tribological experimental setup to study confined and sheared monolayers Review of Scientific Instruments 87, 033903 (2016). [13] O. Benazieb, C. Loison & F. Thalmann, Rheology of sliding leaflets in coarse-grained DSPC lipid bilayers Physical Review E 104, 054802 (2021).
[14] R.Dimova, R. & C.M. Marques (Eds.), The Giant Vesicle Book CRC Press, Taylor and Francis (2019).
[15] M.Er-Rafik et al., Tear of lipid membranes by nanoparticles, Soft Matter 18, 3318-3322 (2022).
[16] M.I. Morandi et al., Accumulation of styrene oligomers alters lipid membrane phase order and miscibility PNAS 118, e2016037118 (2021).
[17] O .Mertins et al., Physical Damage on Giant Vesicles Membrane as a Result of Methylene Blue Photoirradiation Biophysical Journal 106, 162 (2014).
[18]Y. Guo, V.A. Baulin. & F. Thalmann, Peroxidised phospholipid bilayers: insight from coarse-grained molecular dynamics simulations , Soft Matter, 12, 263-271 (2016).
[19] C. F. Su et al., Coarse-Grained Model of Oxidized Membranes and Their Interactions with Nanoparticles of Various Degrees of Hydrophobicity J. Phys. Chem. C 123, 6839-6848 (2019).
[20] M.I. Morandi et al., DPPC Bilayers in Solutions of High Sucrose Content Biophysical Journal 114, 2165 – 2173 (2018).
[21] V. Walter et al., A machine learning study of the two states model for lipid bilayer phase transitions, Physical Chemistry Chemical Physics 22, 19147-19154 (2020)
[22] V. Walter, C. Ruscher, O . Benzerara & F. Thalmann MLLPA : A Machine Learning-assisted Python module to study phase-specific events in lipid membranes, Journal of Computational Chemistry 42, 930-943 (2021).
[23] J. Wolff, Shigeyuki Komura, & David Andelman, Budding transition of asymmetric two-component lipid domains, Physical Review E 94, 032406 (2016).